
头条新闻
上海光源用户揭示人源葡萄糖转运蛋白GLUT1的结构及工作机理
2014年5月18日,清华大学医学院教授颜宁研究组在Nature在线发表了题为“Crystal structure of the human glucose transporter GLUT1”的研究论文,在世界上首次报道了人源葡萄糖转运蛋白GLUT1的晶体结构,初步揭示其工作机制以及相关疾病的致病机理。
葡萄糖(D-glucose)是地球上包括从细菌到人类各种生物已知最重要、最基本的能量来源。葡萄糖代谢的第一步就是进入细胞:亲水的葡萄糖不能自由穿透疏水的细胞膜,其进出细胞需要通过镶嵌于细胞膜上的葡萄糖转运蛋白完成。其中一类属于主要协同转运蛋白超家族(Major Facilitator Superfamily,简称MFS)的转运蛋白是大脑、神经系统、肌肉、红细胞等组织器官中最重要的葡萄糖转运蛋白(glucose transporters,简称GLUTs)。在人体的14个GLUTs中,
GLUT1几乎存在于人体每一个细胞中,是红细胞和血脑屏障等上皮细胞的主要葡萄糖转运蛋白,对于维持血糖浓度的稳定和大脑供能起关键作用。在已知的人类遗传疾病中,导致GLUT1功能异常的突变会影响葡萄糖的正常吸收,导致大脑萎缩、智力低下、发育迟缓、癫痫等一系列疾病。另一方面,当发生癌变时,葡萄糖是肿瘤细胞最主要的能量来源,但是肿瘤细胞由于缺乏氧气供应而只能对葡萄糖进行无氧代谢,同质量葡萄糖所提供的能量不到正常细胞的10%,因而对葡萄糖的需求剧增,在很多种类的肿瘤细胞中都观察到GLUT1的超量表达,以大量摄入葡萄糖维持肿瘤细胞的生长扩增,这使得GLUT1的表达量可能作为检测癌变的一个指标。
自从获得了大量生理、病理、细胞、生化信息之后,获取GLUT1的三维结构就变成了该领域最期待的下一个突破。颜宁研究组在2012年首次解析了GLUTs的大肠杆菌同源蛋白XylE与葡萄糖结合的高分辨率晶体结构,并利用同源建模预测了GLUT1-4的三维结构;时至今日,人源GLUT1蛋白的晶体结构的捕获为理解这个具有历史研究意义的转运蛋白掀开了新的一章。
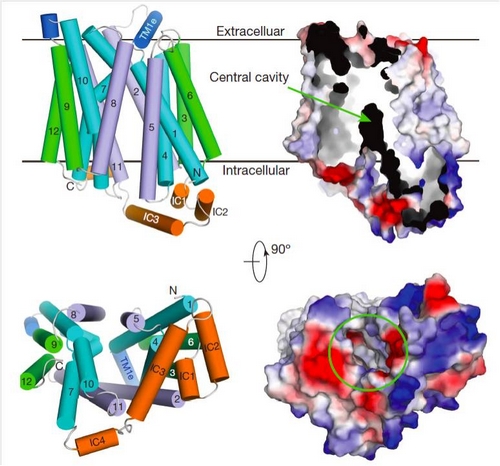
利用上海光源生物大分子晶体学线站(BL17U1)颜宁研究组最终解析了GLUT1的三维晶体结构。GLUT1呈现经典的MFS家族折叠方式——12个跨膜螺旋组成N端和C端两个结构域。两个结构域之间的腔孔朝向胞内区,即该结构呈现向内开放构象。而在结晶中用到的去污剂头部恰好是葡萄糖苷,其结合位点与此前XylE中观测到的葡萄糖结合位点基本重合,证实了MFS家族具有单一结合位点。有趣的是,GLUT1在胞内可溶区还具有一个由4个α螺旋组成的结构域(简称ICH),这一序列只在MFS中的糖转运蛋白亚家族中(Sugar Porter subfamily)观察到,因此ICH是属于该家族蛋白的特有结构特征。
利用GLUT1的晶体结构可以精确地定位与疾病相关的突变氨基酸,揭示其致病机理。分析显示,三十余个突变氨基酸基本集中于三个区域:底物结合区域、胞外门控区、胞内门控区,它们的突变或者影响了底物识别,或者影响转运蛋白的构象变化。晶体结构使得理解这些致病突变的机理一目了然。与之前获得的向胞外半开口的XylE晶体结构比较揭示出
至此,颜宁实验室分别捕获了FucP向胞外开放,XylE结合底物半开放,GLUT1向胞内开放的三个MFS家族最具有代表性的转运状态结构,结构比对初步揭示出MFS糖转运蛋白在转运循环中的构象变化,对于理解MFS家族糖转运蛋白的转运过程提供了重要的分子基础。 (生命科学研究部)
- 关于“重点实验室发表论文署名”的通知
- 祝贺重点实验室2016年的年报在53个未参加过评估的院重点实验室中取得优良结果
- 中国科学院微观界面物理与探测重点实验室开放课题(2017年)申请通知
- 中国科学院微观界面物理与探测重点实验室开放课题(2016年)申请通知
- 学术报告:Fabrication and Applications of Mechanically-Exfoliated Single- and Few-Layer Transition-Metal Dichalcogenides Nanosheets
- 学术报告:Radiation, Health and Society in Nuclear Disaster: Lessons learned from Fukushima and its education implications